ここから本文です。
許可後のGQPとGVP業務について【医薬部外品(GMP対象外)及び化粧品に関する内容】
製造販売業者は製造販売する製品について適正な品質管理を行い、加えて安全性の確保も行わねばなりません。
医薬部外品(GMP対象外)及び化粧品の品質管理にあってはGQP省令注1)で要求する内容に適合し、製造販売後安全管理にあたってはGVP省令注2)で要求する内容に適合している必要があります。
GVP省令及びGQP省令の遵守は製造販売業の許可要件であり、許可後も継続して遵守することが許可を保持するための条件です。
注1)GQP省令=「医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令(平成16年9月22日厚生労働省令第136号)」
注2)GVP省令=「医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令(平成16年9月22日厚生労働省令第135号)」
許可後には薬事監視員が随時に立入調査を行い、管理状況を確認します。
1.適切な業務組織を維持していること。
- 適切な業務を行うための適切な組織を継続して維持していることが必要不可欠です。(下記の図に例示)
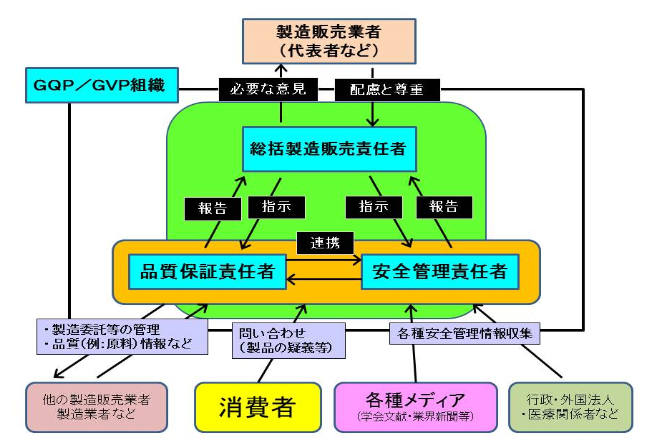
図にあるように、GQP・GVPそれぞれの業務は、総括製造販売責任者が中心となって実施されることとなります。
他に、実務を行う者として、製品の品質保証を行う品質保証責任者、製品の安全管理を行う安全管理責任者を設置し、これら3人注)の責任者により適切な業務を行う必要があります。
これら責任者はそれぞれが密接な連携を図り、取扱う製品が適正なものであることを保証することに加え、消費者、メディア(例:文献・新聞)、工場、行政等から常時情報を収集して製品に関連した情報の確認を行うなど、市場への出荷後も、消費者保護の観点から責任をもって対応を行う必要があります。(実務の要点は、下記4.に示します。)
また、GQP・GVPそれぞれの業務を適正に行うことは製造販売業者(代表者など)の遵守事項であり、自らが設置した総括製造販売責任者の意見を尊重するとともに、必要な配慮を行わねばなりません。(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下、法)第18条第1項に基づく同法施行規則第92条)
注)化粧品製造販売業の場合は、総括製造販売責任者、品質保証責任者、安全管理責任者を1人で兼務することが可能です。ただし、兼務する場合でも、それぞれの責任者の行うべき役割は果たさなくてはなりません。
2.各手順書を適切に管理(保管、改訂など)していること。
業務に関連する手順書を下記に示します。
| GQP業務(品質管理業務)の手順に関する手順書 | GVP業務(安全確保業務)の手順に関する手順書 | ||
|---|---|---|---|
| 1. | 市場への出荷に係る記録の作成 | 1. | 安全管理情報の収集 |
| 2. | 適正な製造管理及び品質管理の確保 | 2. | 安全管理情報の検討及びその結果に基づく安全確保措置の立案 |
| 3. | 品質等に関する情報及び品質不良等の処理 | 3. | 安全確保措置の実施 (安全管理責任者から総括製造販売責任者への報告手順を含む。) |
| 4. | 回収処理 | 4. | 製造販売後安全管理に関する業務に係わる記録の保存 |
| 5. | 文書及び記録の管理 | 5. | その他、製造販売後安全管理に関する業務を適正かつ円滑に実施するために必要な業務 |
| 6. | その他、品質管理業務 | ||
補足
|
|||
3.上記2.の手順書と整合性のある業務を行っていること。
各手順書は非常時マニュアルのような位置づけのものではなく、その内容に則って常時業務を行うものです。
そのため、単に手順書を作成して保管しているだけでは十分な管理状況とは言えません。
常に利用できる場所に備え付け、各業務の記録類の作成方法などを参照できるようにしておく必要があります。
また、各業務の記録類(例:市場への出荷に係る記録 など)は手順書に規定した方法・記録様式にて作成されていることが原則です。
そのため、手順書の規定や記録様式については各企業の業務実態に合わせて適切に改訂されていることが重要です。
手順書と、実際の業務との不整合がないように注意してください。
4.上記1.~3.を前提として、GQP/GVP業務を適切に行っていること。
下記に特に重要なポイントを示しますので業務の参考としてください。
あくまでポイントの提示です。下記以外にも製造販売業者が実施すべき業務がありますので、各企業において薬事法等、各種法令の要求事項を再確認してください。
GQP(品質管理)業務の要点
1.市場へ供給している製品の出荷記録(販売名、ロット番号、出納数量、出荷先等)を作成していること。
回収等の措置が必要となった場合に、大変重要な記録となるものです。
また、回収は一般にロット単位(一連の製造により本質として均質性を有する単位)にて範囲を限定することが多いことから、ロット番号の管理があることも重要です。
ロット単位の出納管理がされていないと、回収が生じた場合に適切な範囲の限定が困難ですので、当該製品の市場流通品の全てを回収対象とする必要があります。
(特に出荷伝票のみで管理している場合には、ロット単位の出納管理を担保出来ていないケースが見受けられます。)
2.市場へ供給している製品が適正かつ円滑に製造されたものであることを確認すること。
2001年4月の薬事法改正により、化粧品については化粧品基準(平成12年厚生省告示第331号)の規定に違反しない成分については、企業責任のもとで安全性を確認した上で配合できる事になりました。
そのため、市場へ供給している化粧品の品質、有効性、安全性の適正については、消費者保護の観点から、各企業が責任をもって評価及び保証することとなります。
特に海外からの輸入にあっては、「海外で販売されているものだから大丈夫。」との説明だけでは適正の評価として十分とは言えません。
例えば、色素、防腐剤(例:ホルマリン、パラベンなど)の許容基準は各国異なるため、海外で流通していても日本においては違反品となる可能性もあるからです。
市場へ供給する製品を企画するときは、化粧品基準をはじめとした規制の内容を踏まえて十分に検討を行ってください。
<参考>
化粧品基準(厚生労働省法令等データベースシステムにて、
- 1)法令検索 情報詳細検索へ
- 2)種別・発翰番号欄へそれぞれ「厚生省告示」「331」号として検索してください。)
また、製造ロット毎に製品の品質が一様ではないことがあります。消費者保護の観点から、工場において適正に製造されたことを確認し、企業として保証できている製品のみを市場へ出荷するようにしてください。
GQP省令(第18条第2項)においては、これらの確認結果を作成することを求めています。
3.製品の品質等に関する情報(例:原料に関する疑義や、消費者からの品質に関する問い合わせなど)について健康に与える影響の評価、原因究明した記録を作成していること。
医薬部外品、化粧品は人体に使用される物であり、その品質に異常(例:異物や変色)があれば重大な健康被害をもたらす可能性を秘めています。
そのため、消費者や製造メーカーからの品質に係る問い合わせなどについては、些細なものであっても記録を行い必要な評価(特に健康へ与える影響の有無)、及び原因究明を行うとともに、必要な改善を行う必要があります。
また、評価及び原因究明の結果、その製品の使用により保健衛生上の危害の発生が考えられる時には、拡大を防止するために、製品の廃棄、回収、販売の停止、情報の提供などの措置を講じる必要があります。(法第68条の9)
GVP(製造販売後安全管理)業務の要点
1.市場へ供給している製品に関する安全管理情報の収集を行い、必要な措置を講じていること
(安全管理情報…製品の品質、有効性及び安全性に関する事項、その他製品の適正な使用のために必要な情報)
新たな科学的見地などにより、取り扱う製品、又はその配合成分の危険性が判明する可能性は常に潜んでいます。
そして、副作用等が発生した場合には厚生労働大臣に報告する必要があります。(法第68条の10)
また、その製品の使用により保健衛生上の危害の発生が考えられる時には、拡大を防止するために、製品の廃棄、回収、販売の停止、情報の提供などの措置を講じる必要があります。(法第68条の9)
上述したように、現在、化粧品の配合成分は、化粧品基準(平成12年厚生省告示第331号)に違反しない範囲において、非常に多種多様です。(企業責任により製品の品質、有効性、安全性を適正に担保してもらう必要があります。)
そのため、GQP業務における品質等に関する情報の他にも、自社が取り扱う製品に関する情報(例:配合成分の安全性 など)について、企業責任において相応しい対象(例:業界新聞や学術文献、消費者、医療関係者、他企業、行政機関など)を規定した上で、それらより常時情報を収集していただく必要があります。
また、製品に関連した情報がなかった場合であっても、業務の実態の記録として収集履歴については残しておくようにしてください。
2.安全確保業務の委託について、適切な契約をした上で運用していること。
市場へ供給されている製品について、薬事上の責任者は製造販売業者となります。
そのため、製品に関連する安全管理情報(製品の品質、有効性及び安全性に関する事項その他製品の適正な使用のために必要な情報)は製造販売業者が確実に把握し、その内容を判断した上で適切に対応する必要があります。
その趣旨から、一連のGVP業務の実施にあたって、製造販売業許可を有する企業において、適正かつ円滑に実施できる能力を有する人員を十分に確保していることが必要です。
ただし、法第18条第3項では、製造販売業者の判断において、他社(適正かつ円滑に業務を行える者)へGVP業務の一端を委託することも可能とされております。
業務委託が可能な範囲は同法施行規則第97条にて規定される範囲内となっており、安全管理情報の収集行為注)についても該当します。
また、製品に関連した安全管理情報についての検討・立案(どういった措置をとるべきか)は、製造販売業者が実施する必要があるため、自ら以外において、適切ではない判断が行われない(または意図している委託業務の範囲を超えない)ように運用することが必須となります。
そのため、委託先業者と必要な契約(下記参考欄参照)を締結し、製造販売業者として責任を持って適切に運用する必要があることに留意してください。
- 委託する業務の範囲を規定すること。
- 委託する業務について、製造販売業者から委託先業者への指示の方法(文書による)を規定すること。
- 委託する業務について、委託先業者から製造販売業者への報告の方法(文書による)を規定すること。
- 製造販売業者が、委託先業者が適正に業務を行っているかを確認できること。また、不備については改善を求め、その改善結果を確認できること。
- 製造販売業者が、委託先業者に、適正な業務を行う上で必要な情報を提供すること。
- 委託先業者が、さらに第三者へ委託を行わないこと(再委託の禁止)。
- 委託先業者における担当者を指定しておくこと。
- その他必要な事項(例:個人情報の取扱いに配慮すること など)
関連法令、通知等:
- 1)法第18条第3項、同法施行規則第97条、第98条、第98条の4(第98条の2の一部準用)
- 2)GVP施行通知(薬食発第0922005号 平成16年9月22日付)など
注)
消費者からの問い合わせには、安全管理情報(製品の品質、有効性及び安全性に関する事項等)が含まれています。
そのため、消費者からの問い合わせを、特定の他社(例:発売元)が受け付けることとなっている場合、通常は該当他社に安全管理情報の収集業務を委託していることになりますので注意してください。