ここから本文です。
医薬品等適合性調査申請(E31,G21)〔承認時・輸出開始時〕の作成方法
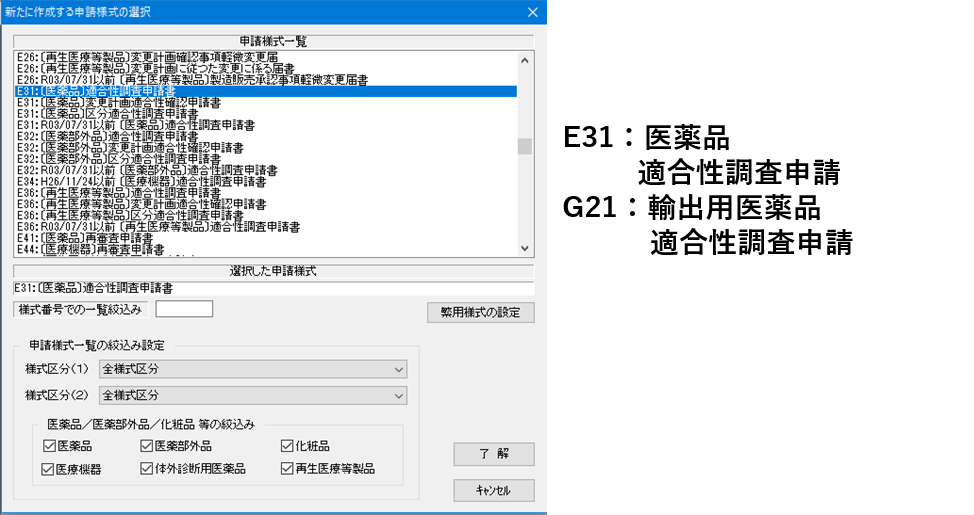
1.「医薬品等電子申請ソフト」の申請書の選択より、適合性調査申請書(E31又はG21)を選択
<申請様式の選択>
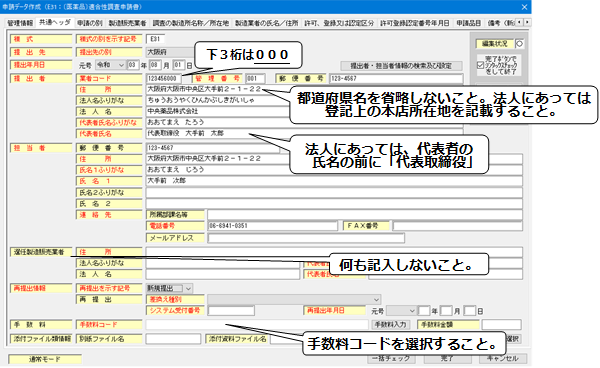
2.「共通ヘッダ」の入力
- 提出者の業者コードは、下3桁が「000」のコードを入力すること。
<共通ヘッダ>
(注意)
- 手数料は以下のコードから選択すること。
「医薬品品目承認審査時適合性調査(無菌)(国内施設)」
「医薬品品目承認審査時適合性調査(一般)(国内施設)」
「医薬品品目承認審査時適合性調査(包装・表示・保管・試験等)(国内施設)」
「医薬品品目承認審査時適合性調査(保管製造所)(国内施設)」
調査が行われる実際の工程が該当する区分に応じて入力すること。
(注意:製造所が有する製造区分とは異なります。)
(例)一般の許可区分を有する製造所への適合性調査申請であるが、調査対象品目は保管のみが行われる場合
↓
手数料コード:「医薬品品目承認審査時適合性調査(包装・表示・保管・試験等)(国内施設)」を選択
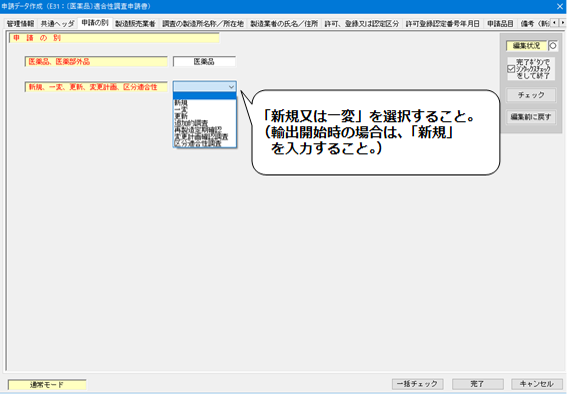
3.「申請の別」の入力
<申請の別>
4.「製造販売業者」の入力
- 「業者コード」は製造販売業許可を取得している場所に付されている業者コードを入力すること。
- 「所在地」は、ビル名などを省略せずに届出されている最新の内容を入力すること。
- 「申請中の情報」については、製造販売業許可更新申請中であっても入力は不要。
<製造販売業者>
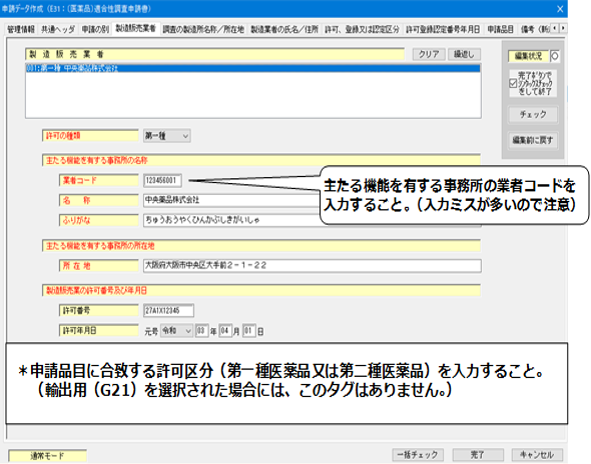
5.「調査の製造所名称/所在地」の入力
- 製造所の業者コードは、下3桁が「000」以外のコードを入力すること。
- 製造所の名称及び所在地は、届出されている最新の内容を入力すること。
<調査の製造所名称/所在地>
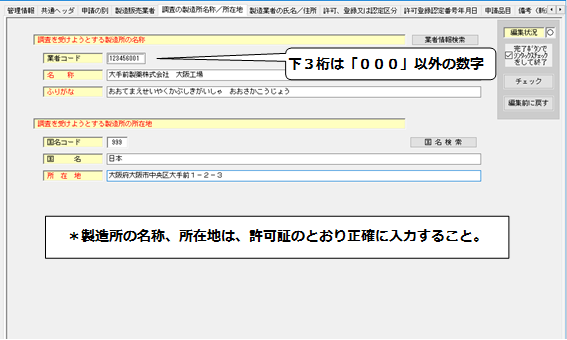
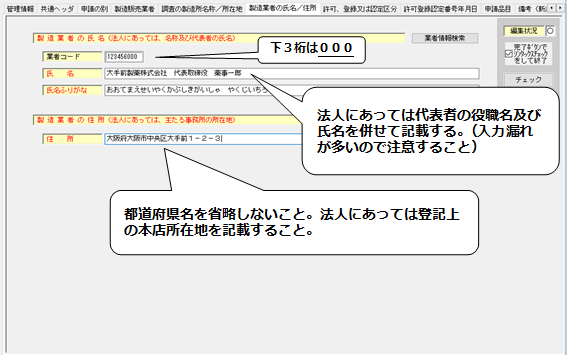
6.「製造業者の氏名/住所」の入力
- 製造業者の業者コードは、下3桁が「000」のコードを入力すること。
- 「氏名」には、法人にあっては代表者の役職名及び氏名を併せて入力すること。
<製造業者の氏名/住所>
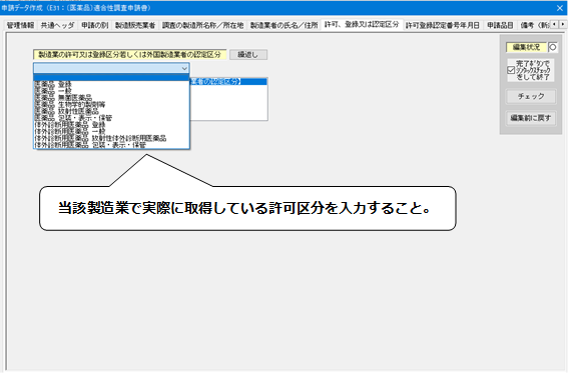
7.「許可、登録又は認定区分」の入力
<許可、登録又は認定区分>
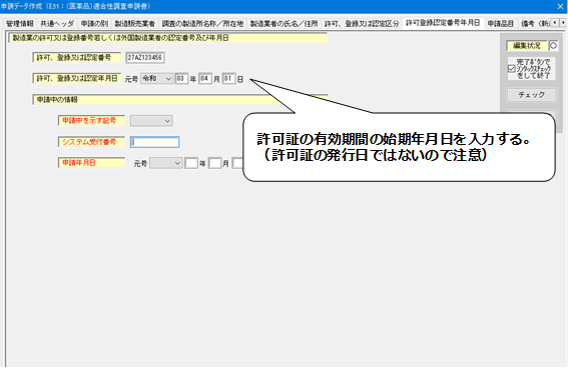
8.「許可登録認定番号年月日」の入力
- 許可、登録又は認定年月日には、有効期間の始期年月日を入力すること。
- 「申請中の情報」については、製造業新規許可・登録申請中の場合のみ入力すること。(申請中を示す記号:1、システム受付番号、申請年月日)
<許可登録認定番号年月日>
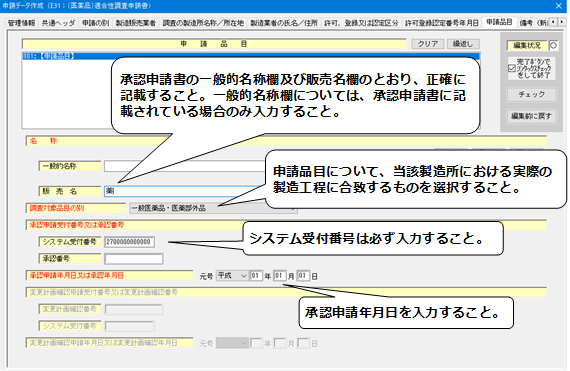
9.「申請品目」の入力
- 「販売名」は、承認申請のとおりに入力すること。
- 「調査対象品目の別」は、当該製造所における実際の製造工程に合致するものを入力すること。
(手数料コードの説明を参照。なお、外試験検査機関の場合には、「包装・表示・保管」を選択すること。) - 「システム受付番号」は、必ず入力すること。(システム受付番号の確認を行うため、FD申請受付票を添付
すること。差換えを実施しており、申請書により確認できる場合には、省略可能。)
<申請品目>(適合性調査申請)
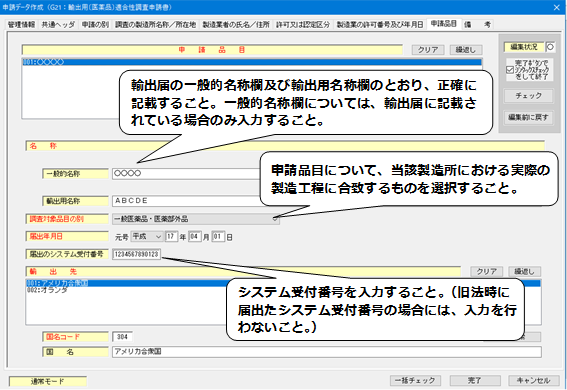
10.「申請品目」の入力
- 「届出のシステム受付番号」には、平成17年4月1日以降の届出の場合には、入力すること。
(平成17年3月31日以前の届出の場合には、入力は不要。) - 「調査対象品目の別」は、当該製造所における実際の製造工程に合致するものを入力すること。
(手数料コードの説明を参照。なお、外試験検査機関の場合には、「包装・表示・保管」を選択すること。)
<申請品目>(輸出用適合性調査申請)
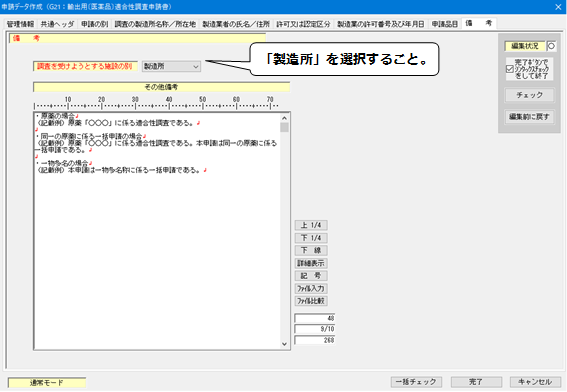
11.「備考(原薬・一物多名称)」の入力
<備考>(原薬・一物多名称)
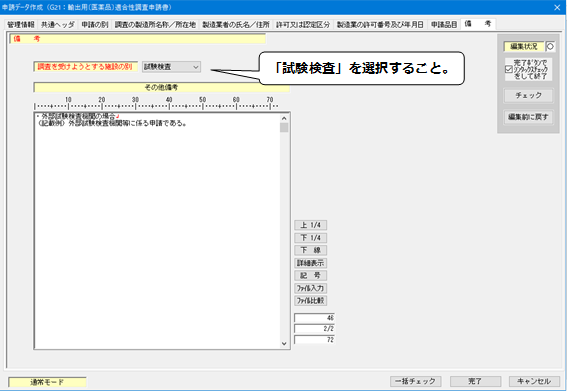
12.「備考(外部試験検査機関)」の入力
<備考>(外部試験検査機関)